车永胜研究团队与张转研究团队合作发表JACS文章:解析真菌毒素erythroskyrines生物合成中一种双功能黄素酶催化环氧化和并呋喃环形成机制
来源:科研处
作者:微生物代谢工程研究室
时间:2026-01-28
浏览次数:
2026年1月12日,中国医学科学院医药生物技术研究所车永胜研究团队与张转研究团队在化学领域顶尖期刊Journal of the American Chemical Society(JACS,IF=15.6)上发表了题为:A Flavin Enzyme Catalyses Epoxidation and Furofuran Formation in the Biosynthesis of Mycotoxin Erythroskyrines的研究论文。该论文阐明了真菌毒素erythroskyrine的两种差向异构体的生物合成途径,并揭示了一个双功能黄素酶亚家族。
真菌毒素erythroskyrine(1)是一类含有[3,2-b]六氢并呋喃环结构的多烯tetramic acid类化合物。并呋喃环结构是药物研发中一个非常有价值的药效基团,例如治疗心绞痛的药物isosorbide,抗炎化合物stachyodin A和JAK3激酶抑制剂12n都具备此类结构。并呋喃环的形成通常依赖黄素酶催化双键环氧化,而环氧中间体的亲核开环则依赖环氧水解酶,其成环路线遵循5-exo-tet Baldwin规则或5-endo-tet anti-Baldwin规则,但是erythroskyrines生物合成过程中负责构建六氢并呋喃环结构的酶学催化机制未有报道,因此研究并呋喃结构的生物合成,具有重要价值。
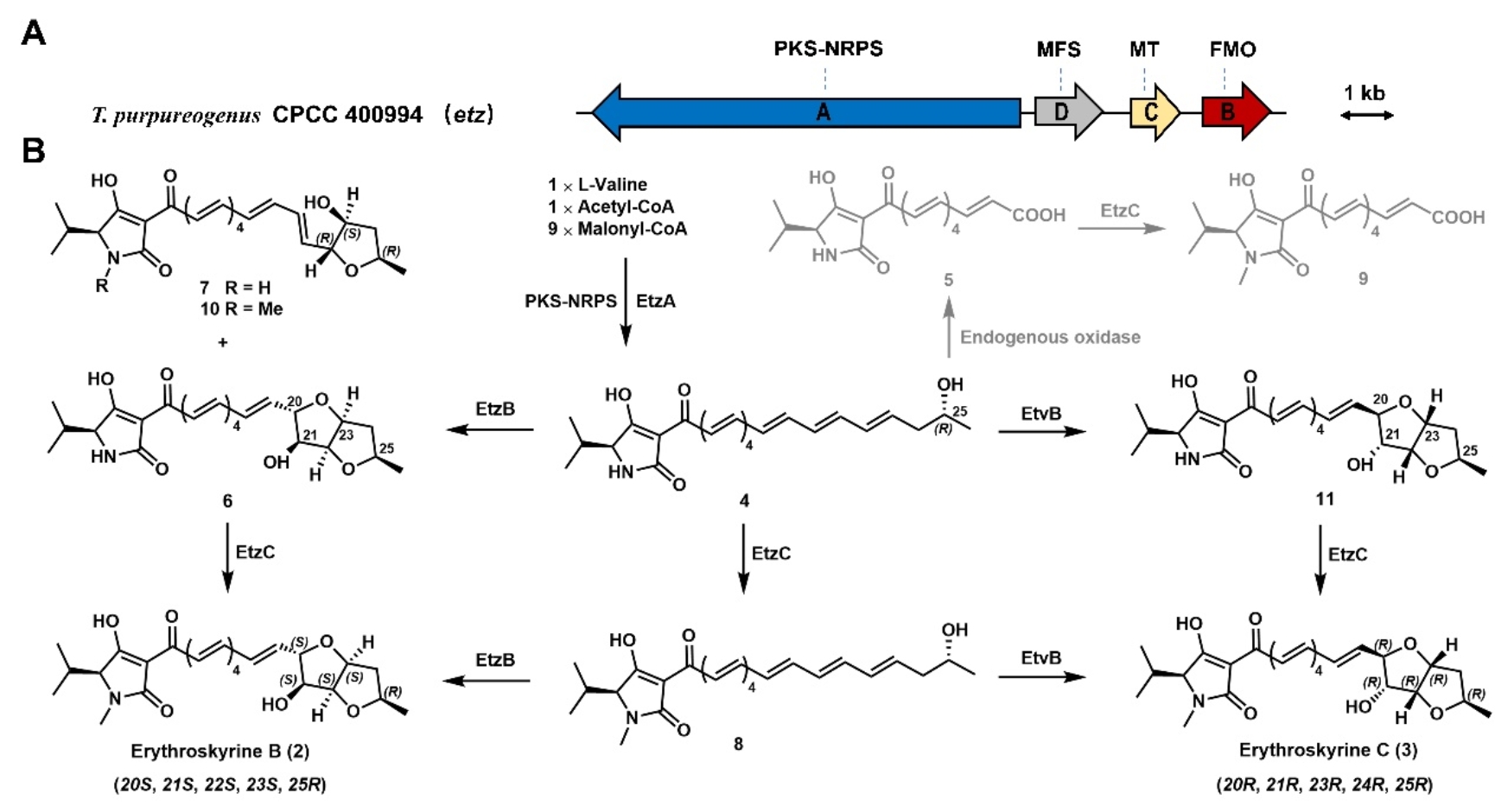
本文通过构巢曲霉异源表达、体外酶学测试和产物结构鉴定首次阐明化合物1的差向异构体化合物erythroskyrine B(2)的生物合成途径。这也是自1965年erythroskyrine(1)发现六十年来首次发现其差向异构体。实验证明,erythroskyrine B(2)生物合成基因簇中不包含环氧水解酶基因,体内和体外实验都表明,这种新颖的并呋喃基团是由一个黄素依赖的单加氧酶EtzB单独催化形成的,该酶连续两轮催化环氧化-环氧开环级联反应形成并呋喃环。
考虑到化合物1和2可能来自相同的PKS-NRPS途径,它们的立体化学差异可能是在环氧化和随后的开环步骤中产生的。为了研究EtzB黄素酶的催化机制,作者进行了同位素标记实验和系统发育树分析,从不同分支中选择四个高同源黄素酶基因进行异源表达、体外酶活实验和产物结构鉴定,发现黄素酶EtvB可以催化产生另外一种erythroskyrine的差向异构体erythroskyrine C(3)。2和3构型不同推测是由EtzB和EtvB催化同一多烯底物时产生了不同的环氧化物中间体。结合密度泛函理论(DFT)指导的反应路线计算和关键分流中间体化合物7结构确证,酶的催化机制概括为:EtzB催化化合物4的环氧化,环氧化物质子化破坏C-O键,产生碳阳离子中间体Int1;随后的分子内SN1亲核加成生成Int2;Int2经历另一轮环氧化-环氧开环最终形成化合物2。值得注意的是,EtzB催化机制不同于先前报道的含并呋喃环天然产物的生物合成途径,这为FAD依赖的单加氧酶催化级联转化建立了新催化范式。
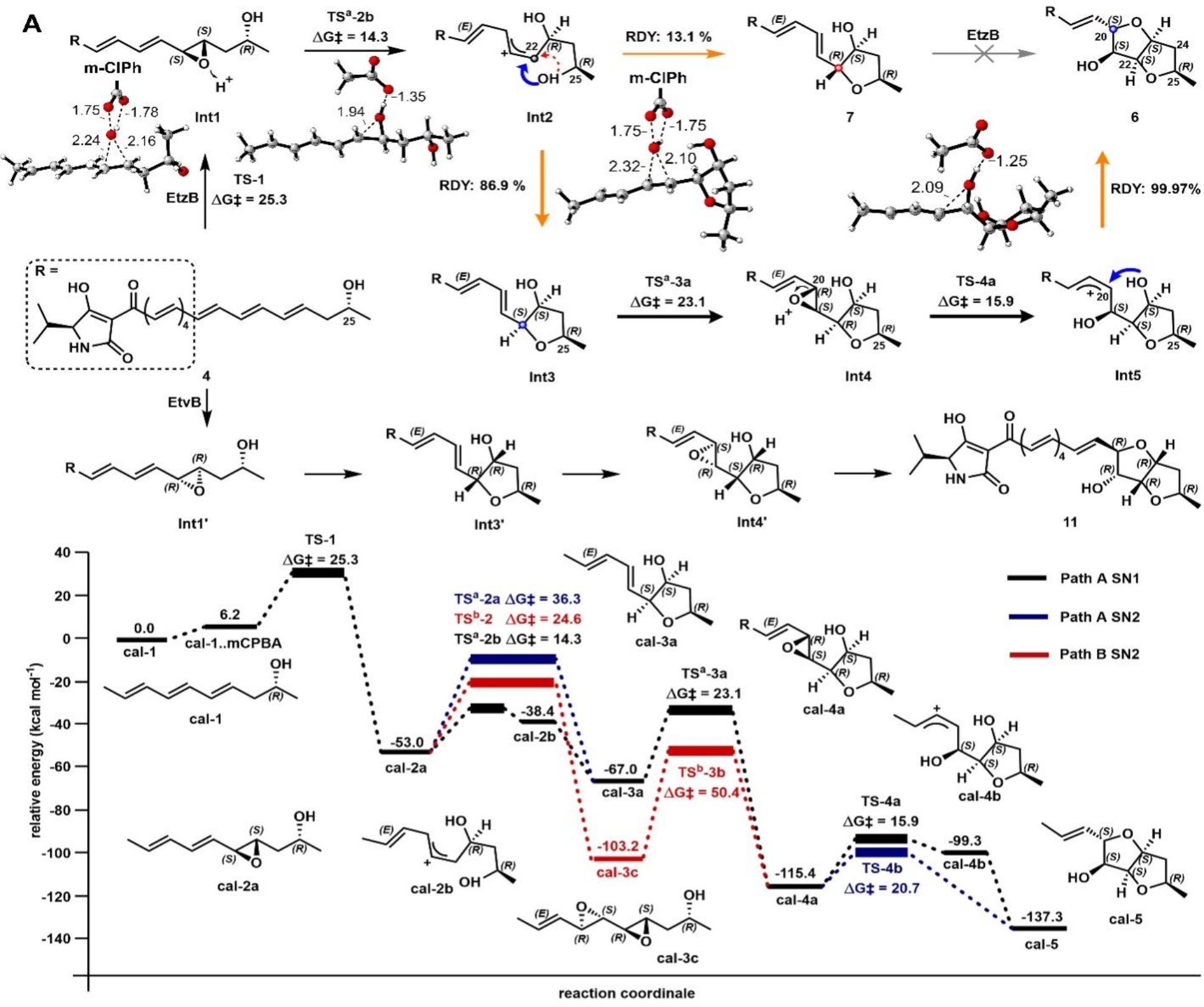
本研究首次发现并阐明了两种erythroskyrine的差向异构体erythroskyrine B(2)和erythroskyrine C(3)的生物合成途径,并揭示了一个双功能黄素酶亚家族,该类酶催化环氧化和环氧开环以对应选择性地产生并呋喃环。相比之下,先前表征的并呋喃环和多环聚醚产生途径通常依赖于环氧化酶-环氧水解酶组合来介导环氧化和随后的环化反应。该类黄素酶催化机制的解析,不仅为FAD依赖的单加氧酶催化级联转化建立了新的催化范式,也对该类活性天然产物的发现和化学产出具有启发意义。
中国医学科学院医药生物技术研究所车永胜研究员和张转研究员为该文共同通讯作者,2022级博士研究生张荣鑫为本文一作,杜潇楠博士提供专业的DFT计算支持。本工作得到中国医学科学院中央级公益性科研院所基本科研业务费(2022-RC350-09)、中国医学科学院医学与健康科技创新工程(2021-I2M-1-030,2023-I2M-2-006)、中国医学科学院生物医学高性能计算平台、国家菌种资源库(NMRC-2025-3)的支持。
车永胜,现任中国医学科学院医药生物技术研究所研究员,长聘教授。在APSB、Small及J. Nat. Prod.等期刊发表责任(含共同)作者论文94篇,获授权专利24件。连续10年入选“中国高被引学者”榜单。课题组研究方向为微生物药源分子的发现与制备技术研究,微生物药源分子的优化、生物合成途径与合成生物学制备技术研究,药物新机制研究,并合作开展临床药物的重定位与新机制研究。
张转,现任中国医学科学院医药生物技术研究所研究员,助理教授。目前以第一或通讯作者在JACS,Angew,Nat. Chem. Biol,PNAS等高水平期刊上发表论文十余篇,入选2022年国家海外青年人才计划。课题组聚焦活性天然产物的挖掘与功能研究,系统解析其生物合成机制,并通过合成生物学与酶工程实现高附加值分子和药物分子的绿色智造。
论文链接:https://pubs.acs.org/doi/full/10.1021/jacs.5c20055




